奥格列隆效果怎么样?
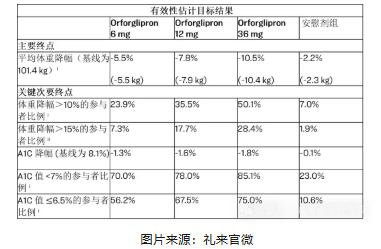
礼来公司(Lilly)的小分子GLP-1R激动剂1类新药奥氟格列隆片(Orforglipron),又翻译成奥格列隆或者奥格列龙,奥格列隆是一款非肽类、小分子口服GLP-1受体激动剂,对饮食或饮水没有限制。最高剂量orforglipron(36mg组)平均体重下降10.4kg(10.5%)。
礼来(Eli Lilly)近日在《新英格兰医学杂志》(NEJM)与第84届美国糖尿病协会(ADA)科学年会上同步公布的Ⅲ期注册项目 ATTAIN-2 与 ACHIEVE-3 完整数据,首次以同行评议形式确认了口服、每日一次的小分子 GLP-1 受体激动剂(GLP-1RA)orforglipron 在“双重代谢负担”人群中的疗效与安全性边界。两项研究合计纳入 2 700 余例受试者,覆盖 BMI ≥27 kg·m⁻² 合并 2 型糖尿病(T2DM)及仅 T2DM 人群,随访周期分别为 72 周与 52 周,主要终点为体重变化百分比及糖化血红蛋白(HbA1c)降幅,关键次要终点包含腰围、收缩压、脂质谱与患者报告结局(PRO)。
一、ATTAIN-2:肥胖合并 T2DM 的“难治”人群获得 10% 量级体重获益
设计:多中心、随机、双盲、安慰剂对照,n=1 032,基线平均 BMI 34.8 kg·m⁻²,HbA1c 8.0%,糖尿病病程 8.3 年。
给药:orforglipron 3 mg→36 mg 滴定组、匹配安慰剂组,均叠加生活方式干预。
结果(72 周,估计目标策略):
- 体重:36 mg 组平均下降 10.4 kg(10.5%),安慰剂校正净获益 −8.1 kg(−8.3%,P<0.001);≥10% 体重应答率 56.3% vs 9.6%。
- 血糖:HbA1c 绝对降幅 1.8%,安慰剂校正 −1.5%;达标率(HbA1c <7%)73% vs 22%。
- 代谢综合征组分:腰围 −9.1 cm,SBP −6.7 mmHg,TG −18%,HDL-C +8%,均达到显著差异。
- 安全性:总体不良事件(AE)发生率 87% vs 82%,因 AE 停药率 11% vs 3%;胃肠道(GI)相关 AE 76% vs 32%,以轻-中度恶心、腹泻为主,呈前 12 周剂量递增期集中出现、此后递减的典型 GLP-1 类时间曲线。未观察到胰腺炎、甲状腺 C 细胞增生或严重低血糖信号。肝肾功能、心电图、降钙素全程无临床意义偏移。

二、ACHIEVE-3:首次头对头击败口服司美格鲁肽,实现“血糖-体重”双终点优效
设计:随机、开放标签、阳性对照、平行组,n=1 704,基线 HbA1c 8.4%,BMI 31.6 kg·m⁻²,二甲双胍单药或联合 SGLT-2i/磺脲背景。
对照:orforglipron 12 mg、36 mg 每日一次 vs 口服司美格鲁肽 7 mg、14 mg 每日一次(诺和诺德 Rybelsus®)。
主要终点(52 周):
1. HbA1c 变化:orforglipron 36 mg 组 −2.2%,司美格鲁肽 14 mg 组 −1.4%,差异 −0.8%(95%CI −0.96 to −0.64,非劣及优效 P<0.001)。
2. 体重变化:orforglipron 36 mg 组 −9.2%(−19.7 lb),司美格鲁肽 14 mg 组 −5.3%(−11.0 lb),差异 −3.9%(相对增幅 73.6%)。
关键亚组:基线 BMI ≥35 kg·m⁻² 者,orforglipron 36 mg 体重降幅达 11.4%,提示小分子 GLP-1RA 在高 BMI 人群存在“体重放大”效应。
其他代谢指标:orforglipron 36 mg 组腰围 −8.4 cm,SBP −5.9 mmHg,Lp(a) −15%,高敏 CRP −42%,均显著优于对照。
安全性:两组 GI AE 谱相似(恶心 39% vs 35%,腹泻 21% vs 18%),但 orforglipron 组轻-中度呕吐发生率略高(13% vs 8%);降钙素、甲状腺超声、淀粉酶/脂肪酶无组间差异;胆囊事件(<0.5%)及轻度注射部位反应(仅参照组)发生率均低。
图片来源:礼来官微
三、机制与临床定位:小分子 GLP-1RA 的“口服便利性+注射级疗效”突破
orforglipron 采用礼来与 Chugai 联合开发的“非肽类、偏向性(biased)GLP-1R 激动剂”平台,分子量 <700 Da,可在空腹状态下经被动扩散迅速吸收,Tmax 1 h,绝对生物利用度 ≈35%,半衰期 24–30 h,支持每日一次给药且不受进食限制。体外实验显示,其在 cAMP 信号通路与 β-arrestin 招募间呈 β-arrestin 偏向,可能部分解释高剂量仍保持可耐受 GI 谱。
相对于肽类口服司美格鲁肽需借助吸收促进剂 SNAC 且需空腹 6 h,orforglipron 服药窗口更宽,患者依从性潜力更高;相对于注射型 GLP-1RA,其免注射、免冷藏的优势可大幅降低治疗启动与维持门槛,尤其适用于需长期体重管理的基层及远程医疗场景。
四、监管与上市展望
礼来已于 2024 Q4 向 FDA 滚动递交 orforglipron 用于肥胖与 T2DM 的 NDA,并同时启动欧盟、日本、中国的全球注册申报。鉴于 ATTAIN-2 与 ACHIEVE-3 均达到主要与关键次要终点,且未发现新的安全性信号,行业预测 FDA 将在 2025 H2 完成审评。若获批,orforglipron 将成为首个“口服小分子 GLP-1RA”,与替尔泊肽(tirzepatide)形成“注射-口服”全谱布局,礼来有望进一步巩固其在代谢领域的龙头地位。
五、对临床实践的影响
1. 治疗序位:对需兼顾减重与降糖的 T2DM 合并肥胖患者,orforglipron 36 mg 提供了与注射 GLP-1RA 同量级的体重获益,却无需注射,可作为“早期强化”选项。
2. 体重管理:在 FDA 已批准的肥胖适应症路径下,orforglipron 10% 级别的减重幅度接近袖状胃切除术(10–15%)的低-中段区间,为拒绝或不适合手术的患者提供替代方案。
3. 支付与可及:小分子化药工艺路线相对简单,成本低于肽类,未来若进入医保目录,有望缓解 GLP-1 类“高价+供应紧张”困局,推动全球肥胖/糖尿病治疗渗透率提升。
结语
ATTAIN-2 与 ACHIEVE-3 的数据共同证实,orforglipron 在“最难减重”的 T2DM 合并肥胖人群中实现了体重 −10%、HbA1c −2% 级别的双重突破,并在头对头研究中击败目前唯一的口服 GLP-1RA 司美格鲁肽。随着全球监管审评的推进,orforglipron 有望重新定义“口服”与“注射”代谢治疗的边界,为亿万患者带来更便捷、可负担且疗效可期的长期管理方案。